“四个最严”“严而又严”的监管新要求,促使全国范围内飞检力度不断加大。其中,冷藏、冷冻药品的储存与运输管理,是药监部门飞检工作的重中之重,也是企业被查缺陷项目的“重灾区”。
笔者以广东省局官网公布的今年5月以来飞检被查出的冷链相关违规情况统计,简要分析药品流通企业冷链管理的主要缺陷类别,并提出解决建议。
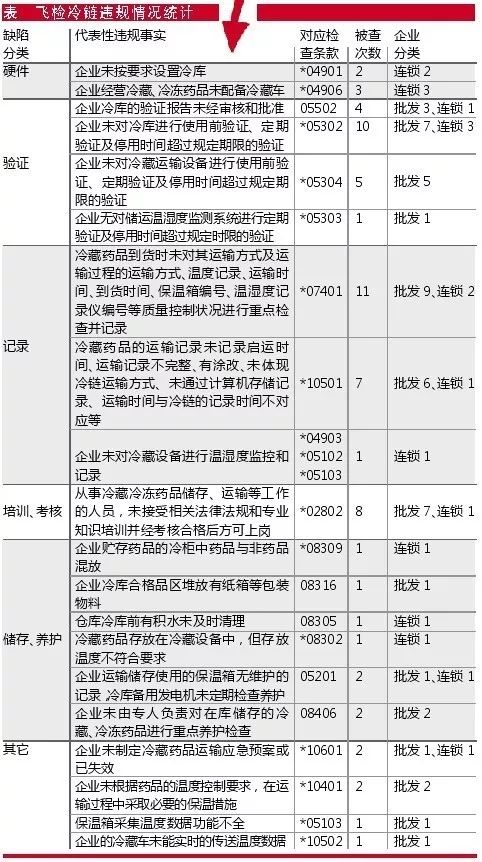
硬件缺陷
部分企业有冷链经营范围,但无实际经营冷链品种或经营量很少,因而配备和维护冷链设备被认为“额外”增加了企业成本负担,导致其存有侥幸心理想蒙混过关。
但是,GSP是药品经营管理和质量控制的基本准则,是合规的依据,不符合要求就是违规经营。
无论有无实际经营、业务量多少,有冷藏、冷冻经营范围的,就必须配备与经营规模和品种相适应的冷库、冷藏车、车载冷藏箱或保温箱,以及温度自动监测、显示、记录、调控、报警等设备。
验证缺陷
由于冷链管理及其相关验证是2013年90号令后新版GSP及附录新增的内容,是全新引入的理念,很多企业缺乏验证相关技术、设备、经验,验证方案不成熟,验证实施过程中相关数据和记录缺少客观性、真实性。甚至有的企业因为冷链方面的业务比较少,想节约成本,就干脆不做验证,留下了一个很大的潜在风险。
出于技术和成本考虑,验证可以考虑请第三方做。相比企业自己做验证,第三方验证拥有更高的权威性、真实性、可信度、实操性。如今第三方验证已经成为一个趋势。飞检新形势下,越来越多企业选择第三方验证,监管部门对第三方验证的认可度也越来越高,既节省钱省时省力,又保证合规,何乐而不为?
需要特别注意的是:1.企业应当根据验证确定的参数及条件,正确、合理使用相关设施设备及监测系统。2.未经验证的设施、设备及监测系统,不得用于药品冷藏、冷冻储运管理。3.验证的结果,应当作为企业制定或修订质量管理体系文件相关内容的依据。
记录缺陷
冷链相关记录,为药品储存与运输环节的质量保证提供了数据支持。储存环节的缺陷相对较少,到货验收与配送运输环节的问题是最多的。
到货验收这块,比较常见的是供应商不配合或不太专业,常因采购量太少、路途太远等原因没能提供完善的冷链配送在途记录。而下游客户又催得急,来不及换别的供应商或找不到别的合格供应商,在采购部或老板的强势干预下冒险把货收下,相关记录再想办法过后补上或根本无法补上,无法保证购入药品的在途质量。配送运输这块,常因冷藏车、冷藏箱、保温箱、温度记录仪等设备无法满足条件或人员操作不当,导致冷链运输记录缺失或有误。
数据和记录不真实也较为常见。不少企业相关人员没有认清形势,还停留于重业务、轻质量。对冷链药品到货“来者不拒”,不管温度有无达标、有无冷链数据、有无冷链交接表,先收再说。而己方配送的冷链药品,由于没有根据验证报告的指导去操作,导致在途温度经常不达标,于是出现数据作假、冒充签名等。
要弥补这方面的缺陷,除了要对首营企业的质量保证能力严格审核之外,还要在验收环节严格把关,加强培训并严格要求相关部门或人员,真实记录和及时收集冷链信息,不符合要求的要拒收,不能受其它部门或人员的干扰,更不能弄虚作假。
培训、考核缺陷
培训、考核方面的缺陷,反映相关岗位人员对冷链管理知识的欠缺、岗前培训的不到位。
按照GSP的要求,从事冷藏、冷冻药品收货、验收、储存、养护、出库、半岛电子平台有哪些公司等岗位的人员,应当接受相关法律法规、专业知识、相关制度和标准操作规程的培训,经考核合格后方可上岗。每年至少开展一次各岗位人员的继续教育培训。培训工作应当做好记录并建立档案。培训档案应包括:培训方案、培训实施(含授课讲义提纲、签到单)、培训考核(试卷)情况等。
储存和养护
储存和养护也是企业对冷藏、冷冻药品容易忽略的方面。
按照GSP要求,药品与非药品、外用药与其他药品应分开存放。药品储存作业区内不得存放与储存管理无关的物品。储存药品应当按照要求采取避光、遮光、通风、防潮、防虫、防鼠等措施。企业应当按包装标示的温度要求储存药品。储存、运输设施设备的定期检查、清洁和维护应由专人负责,并建立记录和档案。养护人员应对储存条件有特殊要求的或者有效期较短的品种进行重点养护。
结语<<<
其它缺陷或常见问题还包括:未制定有效的应急预案,保温措施不足,温度监测数据读取功能不完善,由设备供应商对冷链数据进行记录和管理,备用发电机组或者双回路电路虚设,蓄冷剂未进行验证、直接接触药品等。
山雨欲来风满楼。在药品监管新形势下,飞检已经常态化。药品流通企业要想取得长足发展,就要未雨绸缪、顺势而为,全面落实GSP的各项要求,确保冷藏、冷冻药品流通过程持续合规,确保数据及记录的真实、完整、可追溯。合规经营才是正道!